Cerca de nous antibiòtics per a l’eradicació de biopel·lícules bacterianes mitjançant una llibreria de pèptids
L’abús i mal ús dels antibiòtics convencionals ha propiciat l’aparició de soques bacterianes resistents. Urgeix el desenvolupament de nous agents antimicrobians. En el nostre sistema immunitari trobem un ampli repertori de proteïnes i pèptids amb activitat antimicrobiana. Els pèptids antimicrobians exerceixen una acció ràpida i multifacètica, proporcionant un sistema atractiu alternatiu als antibiòtics convencionals.
El grup de recerca liderat per la Dra. Ester Boix treballa en la caracterització de les ribonucleases humanes de secreció, proteïnes que formen part d’una família específica de vertebrats i participen en el sistema immunitari. En particular, la ribonucleasa 3 és una proteïna altament catiònica segregada pels eosinòfils durant els processos infecciosos. Aquesta proteïna, anomenada també Proteïna Catiònica d’Eosinòfils, té una elevada afinitat pels lipopolisacàrids, molècules aniòniques úniques del embolcall dels bacteris Gram-negatius. La unió de la proteïna a la superfície dels bacteris promou la seva aglutinació i indueix la lisi i mort cel·lular. Curiosament, el segment N-terminal de la proteïna pot reproduir l’activitat antimicrobiana de la proteïna parental.
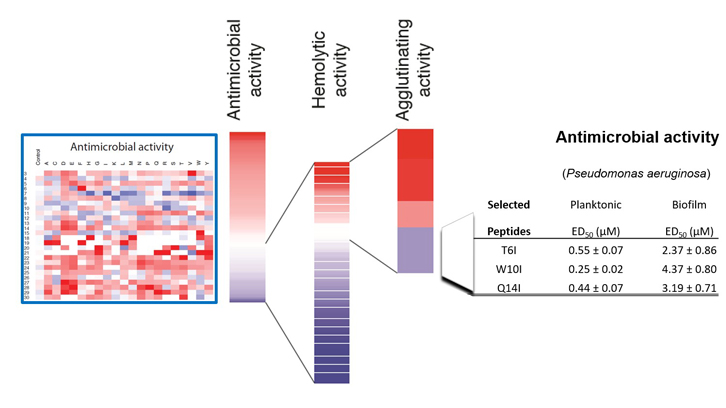
En aquest treball s’ha realitzat el clivatge d’una llibreria de 500 pèptids gràcies a la tècnica de SPOT ideada en el laboratori del Dr. Rudolf Volkmer de la Freie Universität de Berlin. Aquesta tècnica permet la síntesi en un suport de membrana d’un gran nombre de pèptids i facilita la seva avaluació simultània. L’estudi de l’efecte posicional i de composició aminoacídica en cadascuna de les activitats específiques del pèptid original mostra el fràgil equilibri entre la seva capacitat antimicrobiana i potencial toxicitat per les cèl·lules de l’hoste, suggerint que la regió de la proteïna hauria estat optimitzada al llarg de l’evolució per a garantir una eficient activitat bactericida i alhora la seva innocuïtat per l’hoste. Tanmateix, van poder identificar-se unes poques seqüències peptídiques que incrementaven l’activitat antimicrobiana reduint l’activitat hemolítica.
Combinant l’activitat d’aglutinació i lisi cel·lular dels pèptids es va incrementar enormement la seva activitat d’eradicació de biopel·lícules. L’eficiència dels pèptids seleccionats es va avaluar front a una soca de Pseudomonas aeruginosa, espècie que encapçala la llista de priorització de patògens de la Organització Mundial de la Salut per a la cerca de nous fàrmacs.
El pèptid està patentat i properament s’assajarà la seva eficàcia en un model murí d’infecció (projecte finançat pel Programa Indústria del Coneixement, AGAUR: 2016 PROD-00060) amb el cofinançament de la Unió Europea a través del Fons Europeu de Desenvolupament Regional (FEDER))
L’estudi s’ha realitzat en col·laboració amb l’equip del Dr. Rudolf Volkmer (Freie Universität Berlin) i el Dr. David Andreu (Universitat Pompeu Fabra).
Els resultats s’han publicat en la revista European Journal of Medicinal Chemistry:
Facultat de Biociències
Universitat Autònoma de Barcelona
Referències
Pulido D, Prats-Ejarque G, Villalba C, Albacar M, Moussaoui M, Andreu D, Volkmer R, Torrent M, Boix E. Positional scanning library applied to the human eosinophil cationic protein/RNase3 N-terminus reveals novel and potent anti-biofilm peptides. Eur J Med Chem. 2018 May 25;152:590-599. doi: 10.1016/j.ejmech.2018.05.012. Epub 2018 May 8. PubMed PMID: 29763807.