El canal iònic TRPV2 obre camí a teràpies més efectives per a la hipertensió
Investigadors de la UAB han dut a terme dos estudis reveladors sobre TRPV2, un canal iònic fonamental en diverses funcions cel·lulars, que l’assenyala com a possible nova diana terapèutica a l’hora de tractar la hipertensió. Han descobert els efectes dilatadors dels vasos sanguinis que provoca la seva activació i han identificat una molècula capaç d’activar-lo de manera més potent que els fàrmacs coneguts fins a la data.
El canal iònic TRPV2 està format per unes proteïnes que hi ha a la membrana d’algunes cèl·lules i que, quan s’activen, permeten l’entrada d’ions positius del medi extracel·lular. Això canvia l’estat de la cèl·lula, modificant-ne temporalment aspectes com ara la seva capacitat per replicar-se, contraure’s (en el cas d’una cèl·lula muscular) o inclús provocant la seva mort.
TRPV2 són importants en la funció cardíaca i neuromuscular, la immunitat i el metabolisme, i s'associen amb patologies com la distròfia muscular i el càncer. Això no obstant, encara es desconeix en gran mesura la seva capacitat per interaccionar amb altres molècules. Per aquest motiu, en dos estudis liderats per investigadors del Departament de Farmacologia, Terapèutica i Toxicologia, el Departament de Bioquímica i Biologia Molecular i l’Institut de Neurociències de la UAB hem estudiat a fons aquestes proteïnes.
En un primer estudi, coordinat pel grup de recerca que dirigeix el Dr. Francesc Jiménez-Altayó (UAB i CIBERCV), publicat a la revista Life Sciences, vam analitzar en ratolins mascles els mecanismes implicats en la contracció i la relaxació dels vasos sanguinis per activació de TRPV2. Vam veure que TRPV2 produeix múltiples efectes en les diferents capes del vas sanguini, que resulten en vasodilatació.
Això és important perquè és el primer cop que s’identifiquen els processos desencadenats per l’activació de TRPV2 en els vasos sanguinis i que es descriu que condueixen a la dilatació dels mateixos. Aquest estudi suposa un punt de partida molt important per a utilitzar aquesta activació de TRPV2 com a estratègia terapèutica enfront de malalties que cursen amb excessiva vasoconstricció, com podria ser la hipertensió.
En un segon estudi coordinat pel Dr. Álex Perálvarez-Marín, publicat a la revista Computational and Structural Biotechnology Journal, vam emprar tècniques informàtiques (els anomenats anàlisis in silico) per identificar un conjunt de 270 molècules que, per les seves característiques físiques i químiques, podien interaccionar amb TRPV2, i vam agrupar-les per famílies en funció de com cadascuna d’aquestes molècules s’uniria a TRPV2. Aleshores, expressant la proteïna TRPV2 en llevat, vam dissenyar un sistema de cribratge per provar els seus efectes. Això ens va permetre trobar una molècula (el 4-piperidin-1-sulfonil-benzoic) capaç d’activar aquesta proteïna de forma més potent que l’únic fàrmac conegut fins ara que ho feia: el probenecid.
Així doncs, l’activació de TRPV2 produïda per la nova molècula identificada en aquest estudi té un efecte vasodilatador molt interessant que podria ser usat en un futur com a teràpia antihipertensiva. A més, s’ha observat un efecte lligat al sexe dels ratolins, el que obre les portes a una teràpia ajustada i personalitzada a cada pacient, especialment pel fet del biaix de sexe en la prescripció de fàrmacs. Caldrà, però, continuar fent més estudis per conèixer la possible viabilitat i comercialització de la molècula com a medicament.
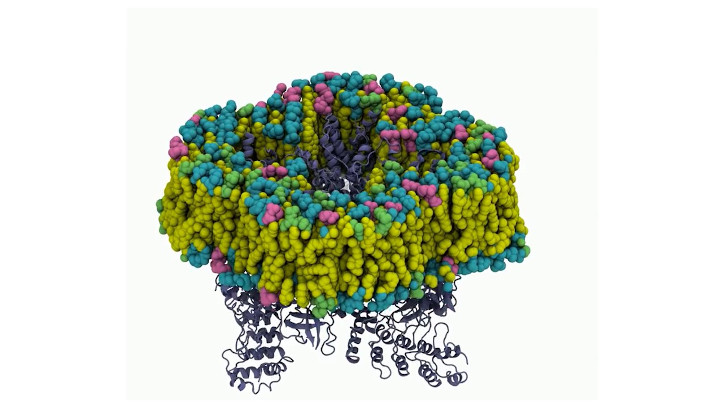
Resum gràfic de l'estructura i la funció del canal iònic TRPV2.
Alex Perálvarez-Marín
Departament de Bioquímica i de Biologia Molecular
Àrea de Bioquímica i de Biologia Molecular
Francesc Jiménez Altayó
Departament de Farmacologia, de Terapèutica i de Toxicologia
Àrea de Farmacologia
Referències
1. Catalina-Hernández È, López-Martín M, Masnou-Sánchez D, Martins M, Lorenz-Fonfria VA, Jiménez-Altayó F, Hellmich UA, Inada H, Alcaraz A, Furutani Y, Nonell-Canals A, Vázquez-Ibar JL, Domene C, Gaudet R, Perálvarez-Marín A. Experimental and computational biophysics to identify vasodilator drugs targeted at TRPV2 using agonists based on the probenecid scaffold. Comput Struct Biotechnol J. 2023 Dec 29;23:473-482. doi: 10.1016/j.csbj.2023.12.028. PMID: 38261868; PMCID: PMC10796807.
2. Perálvarez-Marín A, Solé M, Serrano J, Taddeucci A, Pérez B, Penas C, Manich G, Jiménez M, D'Ocon P, Jiménez-Altayó F. Evidence for the involvement of TRPV2 channels in the modulation of vascular tone in the mouse aorta. Life Sci. 2024 Jan 1;336:122286. doi: 10.1016/j.lfs.2023.122286. Epub 2023 Nov 24. PMID: 38007144.