El medi de cultiu dels micobacteris terapèutics afecta la seva eficàcia en el tractament contra el càncer de bufeta
L'actual tractament per al càncer de bufeta no invasiu consisteix en provocar una resposta antitumoral en l’organisme instil·lant el micobacteri Mycobacterium bovis Calmette-Guérin (BCG) dins la bufeta. Investigadores del Departament de Genètica i de Microbiologia de la UAB han estudiat quins medis de cultiu per al BCG milloren la resposta antitumoral de l’organisme, així com la resposta antitumoral si s'hi instil·la Mycobacterium brumae.
El tractament d'elecció per al càncer de bufeta (CB) no invasiu consisteix en la resecció del tumor seguida d'instil·lacions dins la bufeta d’un bacteri, el Mycobacterium bovis Calmette-Guérin (BCG), que també s’usa com a vacuna per prevenir la tuberculosi. Malgrat ser el tractament més eficaç per a evitar la recurrència i progressió del tumor, el 30% dels pacients no responen a aquesta teràpia, i al voltant del 70% dels malalts sofreixen efectes adversos. Fins i tot, el 8% d'ells han d’interrompre el tractament quedant-se amb escasses alternatives terapèutiques.
El mecanisme d'acció del BCG així com els antígens implicats en la resposta antitumoral no es coneixen, el que implica que es desconegui quins pacients respondran favorablement o no al tractament amb el BCG. De fet, el perfil antigènic del BCG podria ser modificat en funció del medi de cultiu utilitzat per al seu creixement, i en conseqüència, podria alterar el seu efecte antitumoral. En aquest sentit, s'ha observat que el medi de cultiu pot afectar la resposta produïda pel BCG com a vacuna per a la tuberculosi. Les condicions de cultiu del BCG són de rellevant importància ja que la producció del BCG a escala industrial arreu del món es duu a terme usant diferents formulacions del medi de cultiu, podent afectar a l’efecte antitumoral, i sent un paràmetre clau per a entendre l'èxit del tractament. D'altra banda, i en cerca d'una alternativa més segura i/o eficaç al tractament amb el BCG, s'ha descrit l'efecte antitumoral d’un altre micobacteri, el Mycobacterium brumae. El M. brumae és un micobacteri ambiental, no patogen i de creixement ràpid que ha demostrat capacitat immunoterapèutica en estudis preclínics.
L’objectiu principal dels nostres estudis va ser determinar si l’activitat antitumoral del BCG i del M. brumae es veia modificada en funció del medi de cultiu usat pel creixement dels micobacteris. Els micobacteris es van fer créixer en el medi Middlebrook, i tres composicions diferents del medi Sauton usades per fabricants de BCG: Sauton-A60, Sauton-G15 i Sauton-G60. Posteriorment, els micobacteris crescuts en les diferents condicions de cultiu es van utilitzar com a teràpia antitumoral en el model ortotòpic de ratolí de CB.
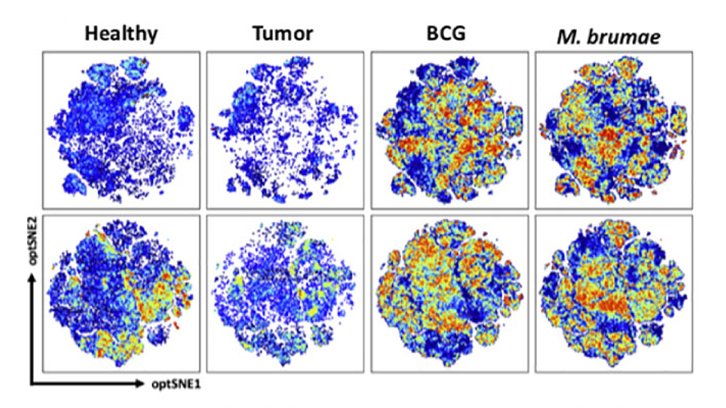
Els resultats van mostrar que cada micobacteri necessita un medi de cultiu específic per a maximitzar la seva activitat. Específicament el M. brumae crescut en Sauton-A60 i el BCG crescut en Sauton-G15 van aconseguir millors resultats en quant a l’eliminació del tumor que la resta de formulacions. Cal destacar, que el M. brumae-A60 va ser el més eficaç entre tots els tractaments provats, incloent-hi totes les condicions del BCG. Va mostrar una major activitat citotòxica de les cèl·lules del sistema immune enfront de cèl·lules tumorals i la major producció d'interleucina IL-17 i d'interferó gamma (IFN-ɣ) a nivell sistèmic. Amb el M. brumae es va observar una infiltració específica i moderada de cèl·lules immunitàries importants per eliminar el tumor a la bufeta: infiltració de cèl·lules linfoides innates i de limfocits T CD4. El BCG-G15 va desencadenar una infiltració massiva de cèl·lules immunitàries, principalment limfocits T (CD4 i CD8) i cèl·lules T Natural Killer (NKT), entre d'altres; a més d'una elevada producció d'IFN-ɣ a nivell sistèmic (Guallar-Garrido et al., 2022; Senserrich et al., 2022).
L’anàlisi de la paret cel·lular del BCG i del M. brumae crescuts en els diferents medis va demostrar que les fórmules més eficaces, el M. brumae-A60 i el BCG-G15, presentaven una menor varietat de lípids en la capa més externa de la micomembrana, en comparació a la resta de cultius de M. brumae i BCG. Aquestes dades suggereixen una clara influència del medi de cultiu en el perfil d'antígens lipídics de la paret cel·lular micobacteriana i en la resposta immunitària antitumoral desencadenada. Aquests resultats contribueixen a entendre com les característiques dels micobacteris són essencials per a crear un microambient tumoral únic que ajuda al sistema immune a alterar les accions immunosupressores del tumor.
El treball s’ha dut a terme al Departament de Genètica i de Microbiologia en estreta col·laboració de la Fundació Germans Trias i Pujol i l’Institut per a la Recerca de la SIDA (IRSI-Caixa), l’Institut de Bioenginyeria de Catalunya, la Facultat de Biologia de la Universitat de Barcelona, l'Unitat de Patologia Murina i Comparada de la Facultat de Veterinària de la UAB, i amb la participació dels Serveis de Ressonància Magnètica Nuclear i Microscopia de la UAB.
Departament de Genètica i de Microbiologia, Facultat de Biociències, Universitat Autònoma de Barcelona
Referències
Guallar-Garrido, S., Campo-Pérez, V., Pérez-Trujillo, M., Cabrera, C., Senserrich, J., Sánchez-Chardi, A., Rabanal, R. M., Gómez-Mora, E., Noguera-Ortega, E., Luquin, M., & Julián, E. (2022). Mycobacterial surface characters remodeled by growth conditions drive different tumor-infiltrating cells and systemic IFN-γ/IL-17 release in bladder cancer treatment. Oncoimmunology, 11(1), 2051845. https://doi.org/10.1080/2162402X.2022.2051845
Senserrich, J., Guallar-Garrido, S., Gomez-Mora, E., Urrea, V., Clotet, B., Julián, E., & Cabrera, C. (2022). Remodeling the bladder tumor immune microenvironment by mycobacterial species with changes in their cell envelope composition. Frontiers in immunology, 13, 993401. https://doi.org/10.3389/fimmu.2022.993401