Les propietats coordinants de les metal·lotioneïnes del C. elegans
Un equip d'investigadors, format per químics de la UAB i biòlegs de la UB, ha estudiat el sistema de metal·lotioneïnes del nematode Caenorhabditis elegans, un organisme model en estudis de biologia molecular. Malgrat que a les metal·lotioneïnes se’ls han atribuït diverses funcions biològiques com la detoxicació de metalls pesants, encara es treballa amb intensitat per determinar la seva funció específica. Aquest treball ha desvetllat les propietats coordinants dels dos tipus de metal·lotioneïnes presents en C. elegans.
Les metal·lotioneïnes (MTs) són metal·loproteïnes de baix pes molecular (d’entre 60 i 100 aminoàcids) molt riques en l’aminoàcid cisteïna (prop d’un 33%). Gràcies a aquest aminoàcid, les MTs tenen una elevada capacitat d’unir metalls. En alguns casos, a més, s’han trobat també histidines coordinant metalls. Malgrat que a les MTs se’ls han atribuït diverses funcions biològiques (detoxicació de metalls pesants, homeòstasi de zinc i coure, propietats antioxidants, etc.), encara es treballa amb intensitat per a determinar la seva funció específica, fet que dificulta llur classificació.
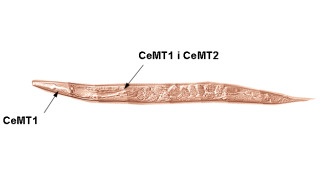
Aquest treball s’ha centrat en el sistema MT del nematode Caenorhabditis elegans, un organisme model en estudis de Biologia Molecular i del Desenvolupament, fet que ha provocat que el seu sistema MT també hagi estat objecte d’atenció especial. En C. elegans existeixen dues MTs, CeMT1 i CeMT2, de 75 i 63 aminoàcids respectivament. Aquestes dues MTs es diferencien entre si principalment per la part final de les seves seqüències (domini C-terminal), on una histidina terminal de CeMT2 és substituïda en CeMT1 per una cua de 15 aminoàcids que inclou 3 histidines i una cisteïna.
Hem estudiat i comparat les capacitats coordinants de CeMT1 i CeMT2 envers el zinc(II), cadmi(II) i coure(I) a partir de la caracterització química dels agregats metall-MT obtinguts per enginyeria genètica. A més, els dos dominis (N-terminal i C-terminal) de les dues MTs s’han caracteritzat separadament, així com una forma mutant de CeMT2 amb una deleció de la histidina terminal (ΔHisCeMT2). Addicionalment, hem identificat i quantificat la contribució de les histidines a la coordinació metàl·lica mitjançant la reacció d’aquests aminoàcids amb productes específics per a histidina.
En aquest treball es demostra que CeMT1 empra les seves histidines, a més de les cisteïnes, per a enllaçar un ió zinc(II) estructural en el domini C-terminal. A més, gràcies a l’estudi comparatiu de les propietats coordinants de CeMT1 i CeMT2 envers els diferents metalls, s’ha observat que les histidines serien les responsables que aquestes MTs tinguin una major preferència per al zinc que per al coure, fet que estaria relacionat amb les diferents funcions fisiològiques que duen a terme aquestes proteïnes dins l’organisme.
Referències
"Caenorhabditis elegans metallothionein isoform specificity - metal binding abilities and the role of histidine in CeMT1 and CeMT2". Bofill, R; Orihuela, R; Romagosa, M; Domenech, J; Atrian, S; Capdevila, M. FEBS JOURNAL, 276 (23): 7040-7056 DEC 2009.