Mecanisme d’activació d’una proteïna termòfila
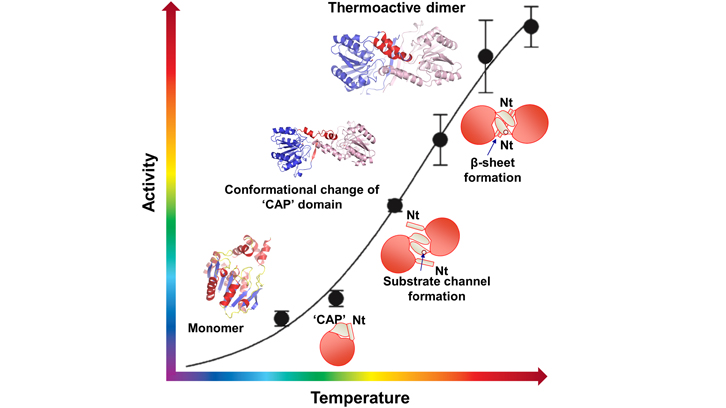
Els enzims esterases i lipases són importants biocatalitzadors en l’àmbit industrial i biotecnològic, ja que poden trencar de forma específica un tipus d’enllaç químic present en quasi tots els tipus de greixos. Aquests enzims es troben presents en quasi tots els dominis de la vida, incloent animals, plantes, bacteris i virus. Concretament l’equip de l’IBB ha treballat amb un membre d’aquesta família d’esterases d’un organisme termòfil anomenat Pyrococcus furiosus, que és capaç de sobreviure en condicions extremes de temperatura de fins a 100 graus centígrads. Aquest fet fa molt atractiu l’ús d’aquests biocatalitzadors en la indústria, on moltes vegades els processos es realitzaren a temperatures extremes, com en el cas de la industria tèxtil, on lipases i esterases d’organismes termòfils juguen un paper molt important en processos com el rentat per l’eliminació de greixos.
El treball presentat és la caracterització de l’activitat biològica des d’un punt de vista estructural d’aquesta esterasa termòfila de Pyrococcus furiosus, on es produeix un procés d’activació de la seva activitat biològica a mesura que augmentem de temperatura. Concretament a temperatures baixes, aquesta proteïna quasi no té activitat esterasa, però a l’arribar a 70-80 graus, ja a prop de la temperatura on viu l’organisme termòfil, s’assoleix el màxim rendiment en l’activitat biològica. En aquest treball, publicat a la revista Structure, es presentan tres estructures tridimensionals d’aquesta proteïna que representen diferents estats funcionals de la proteïna. A baixes temperatures, aquesta esterasa és inactiva i presenta una estructura tridimensional monomèrica, però a mesura que augmentem la temperatura, es produeix un procés de dimerització que fa que l’esterasa adquireixi el màxim d’eficiència de la seva activitat biològica a 70-80 graus.
Aquest mecanisme de regulació de l’activitat per temperatura és una característica única d’aquesta esterasa/lipasa que podria esdevenir de gran importància en la industria biotecnològica per poder regular la seva activitat. Aquest treball s’ha realitzat en col·laboració amb el sincrotró ALBA, on s’ha utilitzat la llum de sincrotró per resoldre l’estructura tridimensional.
Departament de Bioquímica i Biologia Molecular
Universitat Autònoma de Barcelona
Referències
Referència: Varejão, N., De-Andrade, R.A., Almeida, R.V., Anobom, C.D., Foguel, D. & Reverter D. (2017). Structural Mechanism for the Temperature-Dependent Activation of the Hyperthermophilic Pf2001 Esterase. Structure. S0969-2126(17), 30403-30413. DOI: 10.1016/j.str.2017.12.004