Nou mecanisme molecular en la reparació de DNA
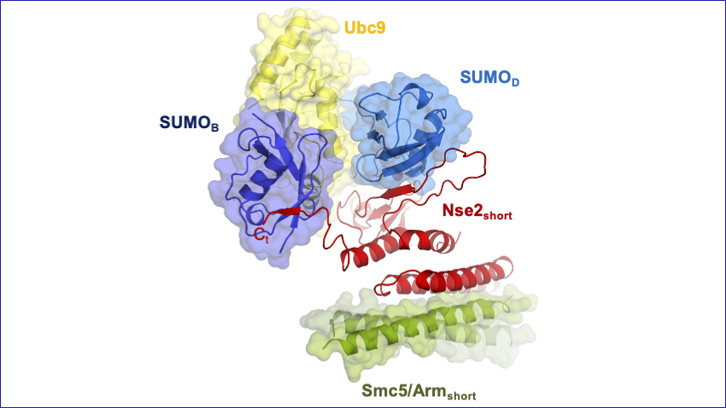
Un estudi liderat per un equip de recerca de l'IBB i del Departament de Bioquímica i Biologia Molecular de la UAB, ha revelat el funcionament d’un complex enzimàtic format per un conjunt de proteïnes: -una E3 lligasa unida a una E2 i a dos SUMO, i ha identificat els punts clau per al funcionament correcte d'aquesta E3 lligasa, que participa en la reparació de dany a l’ADN a través de modificacions post-traduccionals per SUMO.
Les modificacions post-traduccionals de les proteïnes són aquells canvis que es realitzen una vegada la proteïna ja ha estat sintetitzada pel ribosoma. Aquestes modificacions tenen molta importància, ja que poden produir canvis en l'activitat biològica de les proteïnes modificades, generant així un important mecanisme de regulació cel·lular.
SUMO (Small Ubiquitin-like MOdifier) és una proteïna petita que té la capacitat d'unir-se a altres proteïnes a través d’aquestes modificacions post-traduccionals, donant lloc al procés anomenat “SUMOilació”. Hi ha un gran nombre de proteïnes implicades en la SUMOilació, necessàries per la pròpia l'activació de SUMO i també subjectes a aquesta modificació post-traduccional. Entre elles destaca el complex Smc5/6, un complex format per diverses proteïnes que participa activament en la reparació del dany a l'ADN.
En aquest article, presentem l'estructura tridimensional de dues proteïnes del complex Smc5/6, Nse2 i Smc5, interaccionant amb dues proteïnes clau en el procés de SUMOilació: E2 i la pròpia proteïna SUMO unides per un enllaç tioèster. Gràcies a l’observació d'aquest complex enzimàtic, hem pogut definir els punts clau de la unió entre aquestes proteïnes que ens han permès caracteritzar el mecanisme de l'activitat SUMO E3 lligasa de Nse2 i la seva implicació en la reparació de l'ADN.
Aquest treball ha estat realitzat pel grup de recerca dirigit pel Dr. David Reverter, vinculat a l'Institut de Biotecnologia i Biomedicina i al Departament de Bioquímica i Biologia Molecular de la UAB, en col·laboració amb el grup del Dr. Jordi Torres-Rosell, vinculat a l'IRB-Lleida. Les primeres autores de l'article han estat la Dra. Nathalia Varejão i la investigadora predoctoral Jara Lascorz, també pertanyents a l'IBB-UAB.
Institut de Biotecnologia i de Biomedicina (IBB)
Departament de Bioquímica i Biologia Molecular
Universitat Autònoma de Barcelona
Referències
Varejão, N., Lascorz, J., Codina-Fabra, J., Bellí, G., Borràs-Gas, H., Torres-Rosell, J., & Reverter, D. (2021). Structural basis for the E3 ligase activity enhancement of yeast Nse2 by SUMO-interacting motifs. Nature Communications, 12(1), 7013. https://doi.org/10.1038/s41467-021-27301-9


