Rol del residu Gln596 en el funcionament d'ALOX15, un enzim crucial per a la salut
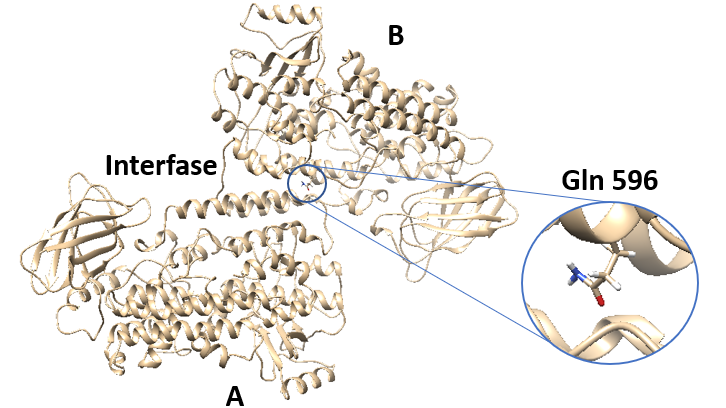
Actualment se sap que malalties com l'arterioesclerosi o l'osteoporosi estan directament relacionades amb l'activitat de l'enzim ALOX15. Un estudi realitzat pel grup de recerca de l'àrea de Física-Química del Departament de Química de la UAB ha observat en diversos experiments l'important paper del residu Gln596 per a l'estabilitat d'aquest enzim, molt important per a controlar el desenvolupament d'aquesta mena d'afeccions.
En el camp de les proteïnes, els enzims 15-lipoxigenasas (ALOX15; arachidonate 15-lipoxygenase) tenen una gran rellevància ja que estan relacionades amb els processos inflamatoris i un gran nombre de malalties, com per exemple l'arterioesclerosi i l'osteoporosi. ALOX15 són uns enzims que contenen ferro, però no un grup hemo, les quals catalitzen la dioxigenación estereoselectiva de l'àcid araquidónico (AA) a una mescla d'àcids 12- i 15- hidroperoxieicosatetranoicos (12- i 15-HpETE) que inicien la biosíntesi de compostos de senyalització que són crucials per a la salut humana.
Encara que ALOX han estat considerades com a enzims monomèrics, dades recents d'ALOX15 de conill en solució aquosa suggereixen que hi ha un equilibri dinàmic entre la forma monomérica i dimérica de l'enzim. Aquest dímer consisteix en dos monòmers (A i B) estructuralment diferents que interaccionen a través d'hèlixs α, concretament les hèlixs α2 i α18 de cada monòmer. Gln 596 és un residu que es troba en la part final de l'hèlix α18 i que es conserva en un gran nombre d'ALOX15 de mamífers. Per tot això, amb l'objectiu de determinar el rol d'aquest residu, s'han realitzat experiments amb ALOX15 de conill, ALOX15 humana i diferents mutants d'aquests enzims, utilitzant diferents substrats. En aquests mutants s'intercanvia Gln 596 per altres residus, les possibles interaccions dels quals diferiran completament de les interaccions del residu en qüestió.
A més, s'han construït mitjançant tècniques computacionals models dimèrics in silico d'ALOX15 de conill i dels diferents mutants considerats per a aquest enzim, amb els quals s'han dut a terme simulacions de dinàmica molecular (DM). En els experiments realitzats en aquest treball s'ha pogut observar que la mutació de Gln 596 indueix una sèrie d'alteracions funcionals en l'enzim, com per exemple en la cinètica de la reacció, en la selectivitat del substrat o en l'especificitat de la reacció. Les nostres simulacions suggereixen que l'origen d'aquests canvis està en el fet que Gln 596 influeix en la geometria del centre catalític mitjançant interaccions indirectes, és a dir, Gln 596 no interacciona directament amb els residus que conformen el centre catalític, sinó que interacciona amb altres residus que són els que influeixen alostéricamente en la forma del centre actiu de l'enzim.
D'altra banda, la mutació d'aquest residu també indueix canvis en l'estructura secundària, la qual perd contingut en hèlixs α en favor de làmines beta i bucles, i en les propietats alostéricas de l'enzim. Això sembla ser pel fet que es perden interaccions entre Gln 596 i l'hèlix α2 del monòmer A, la qual cosa acaba desestabilitzant la formació del dímer i acaba tenint un impacte tant en l'estructura secundària com en les propietats alostéricas.
Les simulacions de DM també han estat claus per a determinar el paper de Gln 596 en la fixació del substrat. A pesar que es creia que era en aquest residu on es fixa el grup carboxilato dels diferents substrats que pot tenir l'enzim, s'ha comprovat que no és així i en cas de produir-se aquesta unió, es tractaria d'una interacció desfavorable des d'un punt de vista de la reactivitat del substrat.
Alejandro Cruz1, Àngels González-Lafont1,2, José M. Lluch1,2
1Departament de Química, Universitat Autònoma de Barcelona.
2Institut de Biotecnologia i de Biomedicina, Universitat Autònoma de Barcelona.
Referències
Cruz, A.; Di Venere, A.; Mei, G.; Zhuravlev, A.; Golovanov, A.; Stehling, S.; Heydeck, D.; Lluch, J. M.; González-Lafont, À.; Kuhn, H.; Ivanov, I. A Role of Gln596 in Fine-Tuning Mammalian ALOX15 Specificity, Protein Stability and Allosteric Properties. Biochim. Biophys. Acta - Mol. Cell Biol. Lipids 2020, 1865 (7), 158680. https://doi.org/10.1016/j.bbalip.2020.158680.


