Un nuevo estudio demuestra que los conejos no son resistentes a la infección por priones
Un proyecto llevado a cabo en el IRTA-CReSA (Barcelona) y el CNB (Madrid), liderado por el CIC bioGUNE (Bilbao), demuestra que los conejos son susceptibles a las encefalopatías espongiformes, enfermedades neurodegenerativas causadas por priones. La investigación, que ha sido publicada en la revista PLoS Pathogens, ha utilizado priones reales que se encuentran especies ganaderas. Las conclusiones de este estudio son útiles para evaluar correctamente los riesgos asociados a la alimentación de algunas especies, como los conejos, que se destinan al consumo humano.
Una investigación coordinada por el centro de investigación cooperativa en biociencias CIC bioGUNE ha demostrado in vivo que los conejos no son resistentes a las encefalopatías espongiformes, enfermedades neurodegenerativas causadas por priones, aunque sí parecen mostrar una resistencia superior a otros mamíferos. El estudio, liderado por el Dr. Joaquín Castilla, se ha realizado en las instalaciones de bioseguridad de nivel 3 del IRTA-CReSA bajo la dirección del Dr. Enric Vidal y ha contado con la colaboración de la Dra. Belén Pintado del CNB. El proyecto ha sido financiado por el MINECO (AGL2008-05296-C02). El estudio se ha prolongado durante cuatro años y ha sido recientemente publicado en la prestigiosa revista PLoS Pathogens.
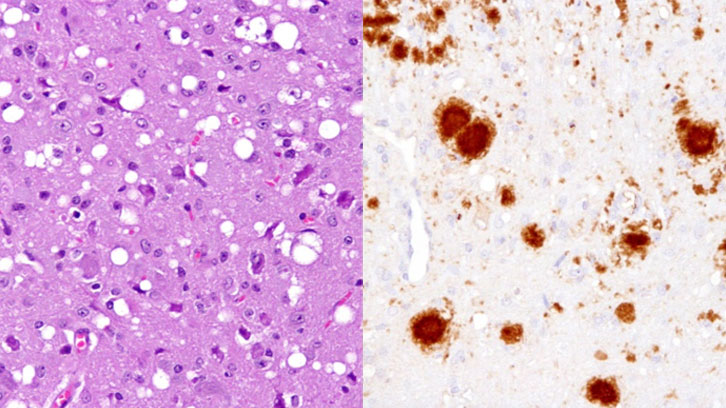
Los priones son una versión anómala e infecciosa de la proteína PrP, que en su estado benigno se encuentra en las neuronas de todos los mamíferos. Cuando un prión –palabra derivada de “partícula proteica infecciosa”– se introduce en un organismo sano, actúa sobre la forma normal de la proteína, causa su mal plegamiento y la convierte en un nuevo prión. La acumulación de estas proteínas anómalas e infecciosas activa la muerte neuronal y desencadena las denominadas encefalopatías espongiformes, enfermedades neurodegenerativas que no disponen de cura ni tratamiento y reciben este nombre por el aspecto horadado que presenta el encéfalo de los ejemplares enfermos si se observa en el microscopio. Una de las más conocidas es la que afecta los bovinos, denominada popularmente como el mal de las vacas locas.
Para llevar a cabo la investigación, se ha diseñado, en el Centro Nacional de Biotecnología CNB-CSIC, una línea de ratones transgénicos a los que se les sustituyó el gen que codifica la proteína PrP de ratón por la correspondiente al conejo. “Se trata de modelos más pequeños que los lepóridos, pero que representan muy bien al conejo real y debido a su coste más económico nos permiten llevar a cabo la investigación con un número mucho más significativo de ejemplares”.
Los ratones transgénicos fueron posteriormente inoculados, en la unidad de biocontención de nivel 3 del CReSA, con priones circulantes reales de oveja, vaca, ratón y ciervo y los investigadores observaron que los animales desarrollaban una encefalopatía espongiforme con los priones aislados de vaca, ratón y oveja. Sin embargo, no se produjo infección con el prión procedente del ciervo. “Durante 40 años se pensaba que la proteína del conejo no se podía mal plegar. Sin embargo no es así y éste es el primer hecho que hemos demostrado. No hay nada en la proteína del conejo que la haga resistente al mal plegamiento”.
En 2012, el equipo dirigido por Castilla puso la primera piedra al confirmar la infección de conejos utilizando un prión de síntesis diseñado en el laboratorio, pero el estudio actual supone la verificación in vivo, con priones reales que se encuentran regularmente especies ganaderas. “Estas conclusiones deben ser tomadas en cuenta en la alimentación de los conejos, especialmente si se usan piensos que contengan proteína animal”.
Diferentes estudios, conclusiones idénticas
Además de estos resultados, se publica en el mismo número de la revista un estudio que científicos del Instituto de Investigación Agronómica de Francia (INRA) han llevado a cabo directamente con conejos transgénicos a los que se les introdujo el gen de la proteína PrP de origen ovino. Posteriormente, los investigadores les inocularon priones ovinos y observaron que pasados entre 6 y 8 meses los conejos enfermaban de una encefalopatía espongiforme, por lo que ese estudio también concluye que no hay ningún elemento en el resto del genoma de los conejos que los haga resistentes.
¿Por qué es tan difícil volver loco al conejo?
Durante 4 décadas se ha creído que los lepóridos eran resistentes a la infección por priones, basándose en la inexistencia de encefalopatías espongiformes en conejos. Las investigaciones más recientes han refutado esa teoría y de momento no han sido capaces de desvelar las causas por las que los conejos parecen ser más resistentes a las dolencias priónicas que el resto de mamíferos. La ausencia de casos de conejos con esta enfermedad podría residir en el hecho de que los lepóridos no han sido tan expuestos a piensos derivados de proteína animal infectada como sucedió con otras especies. Otra de las claves radica en la edad del animal. Las encefalopatías espongiformes presentan un tiempo de incubación generalmente prolongado y los conejos son sacrificados en edades muy tempranas.
Los priones son una versión anómala e infecciosa de la proteína PrP, que en su estado benigno se encuentra en las neuronas de todos los mamíferos. Cuando un prión –palabra derivada de “partícula proteica infecciosa”– se introduce en un organismo sano, actúa sobre la forma normal de la proteína, causa su mal plegamiento y la convierte en un nuevo prión. La acumulación de estas proteínas anómalas e infecciosas activa la muerte neuronal y desencadena las denominadas encefalopatías espongiformes, enfermedades neurodegenerativas que no disponen de cura ni tratamiento y reciben este nombre por el aspecto horadado que presenta el encéfalo de los ejemplares enfermos si se observa en el microscopio. Una de las más conocidas es la que afecta los bovinos, denominada popularmente como el mal de las vacas locas.
Para llevar a cabo la investigación, se ha diseñado, en el Centro Nacional de Biotecnología CNB-CSIC, una línea de ratones transgénicos a los que se les sustituyó el gen que codifica la proteína PrP de ratón por la correspondiente al conejo. “Se trata de modelos más pequeños que los lepóridos, pero que representan muy bien al conejo real y debido a su coste más económico nos permiten llevar a cabo la investigación con un número mucho más significativo de ejemplares”.
Los ratones transgénicos fueron posteriormente inoculados, en la unidad de biocontención de nivel 3 del CReSA, con priones circulantes reales de oveja, vaca, ratón y ciervo y los investigadores observaron que los animales desarrollaban una encefalopatía espongiforme con los priones aislados de vaca, ratón y oveja. Sin embargo, no se produjo infección con el prión procedente del ciervo. “Durante 40 años se pensaba que la proteína del conejo no se podía mal plegar. Sin embargo no es así y éste es el primer hecho que hemos demostrado. No hay nada en la proteína del conejo que la haga resistente al mal plegamiento”.
En 2012, el equipo dirigido por Castilla puso la primera piedra al confirmar la infección de conejos utilizando un prión de síntesis diseñado en el laboratorio, pero el estudio actual supone la verificación in vivo, con priones reales que se encuentran regularmente especies ganaderas. “Estas conclusiones deben ser tomadas en cuenta en la alimentación de los conejos, especialmente si se usan piensos que contengan proteína animal”.
Diferentes estudios, conclusiones idénticas
Además de estos resultados, se publica en el mismo número de la revista un estudio que científicos del Instituto de Investigación Agronómica de Francia (INRA) han llevado a cabo directamente con conejos transgénicos a los que se les introdujo el gen de la proteína PrP de origen ovino. Posteriormente, los investigadores les inocularon priones ovinos y observaron que pasados entre 6 y 8 meses los conejos enfermaban de una encefalopatía espongiforme, por lo que ese estudio también concluye que no hay ningún elemento en el resto del genoma de los conejos que los haga resistentes.
¿Por qué es tan difícil volver loco al conejo?
Durante 4 décadas se ha creído que los lepóridos eran resistentes a la infección por priones, basándose en la inexistencia de encefalopatías espongiformes en conejos. Las investigaciones más recientes han refutado esa teoría y de momento no han sido capaces de desvelar las causas por las que los conejos parecen ser más resistentes a las dolencias priónicas que el resto de mamíferos. La ausencia de casos de conejos con esta enfermedad podría residir en el hecho de que los lepóridos no han sido tan expuestos a piensos derivados de proteína animal infectada como sucedió con otras especies. Otra de las claves radica en la edad del animal. Las encefalopatías espongiformes presentan un tiempo de incubación generalmente prolongado y los conejos son sacrificados en edades muy tempranas.
Enric Vidal
Laboratori PRIOCAT - SESC (Suport a Escorxadors) - Diagnòstic TBC
Centre de Recerca en Sanitat Animal (CReSA)
IRTA
Centre de Recerca en Sanitat Animal (CReSA)
IRTA
Referencias
Vidal, E.; Fernández-Borges, N.; Pintado, B.; Eraña, H.; Ordóñez, M.; Márquez, M. et al. Transgenic Mouse Bioassay: Evidence That Rabbits Are Susceptible to a Variety of Prion Isolates. PLoS Pathogens. 2015, vol. 11, num. 8, e1004977. doi: 10.1371/journal.ppat.1004977.