Detecten el mecanisme pel qual les cèl·lules resisteixen la quimioteràpia
Un dels mecanismes més importants responsable de reparar mutacions al nostre genoma és la ruta supressora del càncer anomenada "Anèmia de Fanconi/BRCA". Aquest mecanisme permet a les cèl·lules identificar mutacions genètiques per tal de corregir-les.
Un mal funcionament d'aquest mecanisme provoca l'Anèmia de Fanconi, una malaltia genètica rara que es caracteritza per l'aparició d'anèmia progressiva, diverses malformacions congènites i una elevadíssima predisposició al càncer.
D'altra banda, les proteïnes implicades en aquesta ruta són, en gran part, responsables de la resistència dels tumors a molts agents antitumorals com el cisplatí o altres quimioteràpics destinats a matar les cèl·lules tumorals produint enllaços creuats en el seu DNA. És a dir: identifiquen les alteracions cel·lulars que provoca la quimioteràpia i les corregeixen, actuant "accidentalment" a favor del tumor.
Molts tumors tenen anomalies moleculars en aquesta ruta. Gràcies a aquests defectes, els tumors poden tractar-se de manera eficient amb determinats agents antitumorals. Hi ha, com a mínim, 13 gens implicats en la ruta. Tres d'ells (BRCA2, BRIP1 y PALB2) són responsables d'una elevada proporció de càncers de mama hereditaris (entre el 5% i el 10% del total de càncers de mama).
Saber com funciona aquesta ruta reparadora del DNA és de gran interès biomèdic no només per als pacients d'Anèmia de Fanconi, sinó també per a la població oncològica en general, ja que determina l'eficàcia de la quimioteràpia en un gran nombre de tumors. El fet, però, que al menys 13 gens estiguin implicats en la mateixa ruta, dificulta enormement el seu estudi.
Un equip d'investigadors del Grup de Mutagènesi de la UAB, dirigit pel doctor Jordi Surrallés, ha aclarit un dels interrogants principals d'aquesta ruta: com les proteïnes Fanconi reconeixen la presència de mutacions per poder després reparar-les.
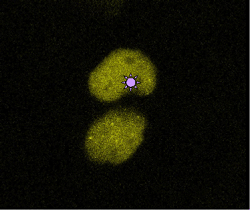
Els investigadors han descobert que les mutacions bloquegen el procés de còpia (replicació) del DNA, procés necessari -sobretot en teixits tumorals- per a que les cèl·lules puguin dividir-se i proliferar. En bloquejar el procés de còpia, s'activa un tipus d'enzim, la quinasa ATR, que "fosforila" (introdueix grups fosfat) una proteïna present a la cromatina que envolta el DNA danyat, la histona H2AX. Aleshores, la histona H2AX fosforilada indica la localització del dany genètic a les proteïnes Fanconi i les posiciona al lloc precís on cal reparar el DNA.
Els investigadors han demostrat que una de les 13 proteïnes Fanconi, la FANCD2, s'uneix directament a la histona H2AX fosforilada. En aquest procés intervé també una altra proteïna, BRCA1, que està implicada, juntament amb BRCA2, en la majoria de càncers de mama hereditaris. Així doncs, aquestes proteïnes cooperen en la reparació el dany genètic, preservar l'estabilitat dels cromosomes i evitar l'oncogènesi.
Les futures implicacions biomèdiques d'aquesta recerca són múltiples. El millor coneixement d'aquesta ruta permetrà de dissenyar estratègies per quimiosensibilitzar cèl·lules tumorals. En aquesta línia, l'equip del doctor Jordi Surrallés ha observat també que nombroses línies cel·lulars derivades del càncer de mama són entre 2 i 3 cops més sensibles a la quimioteràpia després d'inhibir parcialment l'expressió del gen Fanconi FANCD2.
Els resultats d'aquest estudi, realitzat íntegrament al Departament de Genètica i Microbiologia de la UAB, s'ha publicat a la revista The EMBO Journal. La major part del treball ha estat realitzat pels investigadors postdoctorals Massimo Bogliolo i Alex Lyakhovich. El Grup del doctor Jordi Surrallés està finançat per la Comissió de la UE, els fons FEDER, el Ministeri d'Educació i Ciència, el Ministeri de Sanitat i Consum, la Fundació "la Caixa", la Fundació Genoma España i el Centro de Investigación Biomédica en Red en Enfermedades Raras (CIBER-ER).