Detectan el mecanismo por el cual las células resisten a la quimioterapia
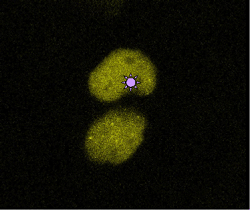
Uno de los mecanismos más importantes responsable de reparar mutaciones en nuestro genoma es la ruta supresora del cáncer denominada "Anemia de Fanconi/BRCA". Este mecanismo permite a las células identificar mutaciones genéticas para luego corregirlas.
Un mal funcionamiento de este mecanismo provoca la Anemia de Fanconi, una enfermedad genética rara que se caracteriza por la aparición de una anemia progresiva, varias malformaciones congénitas y una elevadísima predisposición al cáncer.
Por otro lado, las proteínas implicadas en esta ruta son, en gran parte, responsables de la resistencia de los tumores a muchos agentes antitumorales como el cisplati u otros quimioterapicos destinados a matar las células tumorales produciendo enlaces cruzados en su DNA. Es decir: identifican las alteraciones celulares que provocan la quimioterapia y las corrigen, actuando "accidentalmente" a favor del tumor.
Muchos tumores tienen anomalías moleculares en esta ruta. Gracias a estos defectos, los tumores pueden tratarse de manera eficiente con determinados agentes antitumorales. Hay, como mínimo, 13 genes implicados en la ruta. Tres de ellos (BRCA2, BRIP1 y PALB2) son responsables de una elevada proporción de cánceres de mama hereditarios (entre el 5% y el 10% del total de cánceres de mama).
Saber cómo funciona esta ruta reparadora del DNA es de gran interés biomédico no sólo para los pacientes de Anemia de Fanconi, sino también para la población oncológica en general, puesto que determina la eficacia de la quimioterapia en un gran número de tumores. El hecho, pero, que al menos 13 genes estén implicados en la misma ruta, dificulta enormemente su estudio.
Un equipo de investigadores del Grupo de Mutagènesi de la Universidad Autónoma de Barcelona, dirigido por el doctor Jordi Surrallés, ha aclarado una de las interrogantes principales de esta ruta: cómo las proteínas Fanconi reconocen la presencia de mutaciones para después poder repararlas.
Los investigadores han descubierto que las mutaciones bloquean el proceso de copia (replicación) del DNA, proceso necesario -sobre todo en tejidos tumorales- para que las células puedan dividirse y proliferar. Al bloquear el proceso de copia, se activa un tipo de enzima, la quinasa ATR, que "fosforila" (introduce grupos fosfato) una proteína presente en la cromatina que rodea el DNA dañado, la histona H2AX. Entonces, la histona H2AX fosforilada indica la localización del daño genético a las proteínas Fanconi y las posiciona al lugar preciso dónde hace falta reparar el DNA.
Los investigadores han demostrado que una de las 13 proteínas Fanconi, la FANCD2, se acopla directamente a la histona H2AX fosforilada. En este proceso interviene también otra proteína, BRCA1, que está implicada, junto con BRCA2, en la mayoría de cánceres de mama hereditarios. Así pues, estas proteínas cooperan en la reparación del daño genético, preservan la estabilidad de los cromosomas y evitan la oncogénesis.
Las futuras implicaciones biomédicas de este estudio son múltiples. El mejor conocimiento de esta ruta permitirá diseñar estrategias para quimiosensibilizar células tumorales. En esta línea, el equipo del doctor Jordi Surrallés ha observado también que numerosas líneas celulares derivadas del cáncer de mama son entre 2 y 3 veces más sensibles a la quimioterapia después de inhibir parcialmente la expresión del gen Fanconi FANCD2.
Los resultados de este estudio, realizado íntegramente en el Departamento de Genética y Microbiologia de la UAB, se ha publicado en la revista The EMBO Journal. La mayor parte del trabajo ha sido realizado por los investigadores postdoctorals Massimo Bogliolo y Alex Lyakhovich. El Grupo del doctor Jordi Surrallés está financiado por la Comisión de la UE, los fondos FEDER, el Ministerio d’Educación y Ciencia, el Ministerio de Sanidad y Consumo, la Fundación "la Caixa", la Fundación Genoma España y lo Centro de Investigación Biomédica en Red en Enfermedades Raras (CIBER-ER).