Resposta cel·lular a un mal plegament de proteïnes
El mal plegament i l’agregació de proteïnes estan associats a nombroses malalties degeneratives com ara la diabetis-tipus-II o l’Alzheimer. Malgrat això, les proteïnes propenses a agregar semblen estar conservades en tots els regnes de la vida. De fet, hi ha un nombre creixent d’exemples en els quals les cèl·lules utilitzen els agregats de proteïnes per a propòsits funcionals, com l’arranjament de la melanina a la pell o l’emmagatzematge de memòria. En conseqüència, durant la seva evolució, les cèl·lules han hagut de desenvolupar diferents estratègies per tolerar i controlar el procés d’agregació.
Una de les principals línies de recerca del nostre grup és l’estudi del mal plegament i l’agregació de proteïnes relacionades amb la malaltia. Estudiem aquest fenomen des d’un punt de vista biofísic, per conèixer les propietats de les proteïnes que estan involucrades en aquest esdeveniment, i també utilitzant models vius, per entendre la seva relació amb les malalties i les funcions cel·lulars.
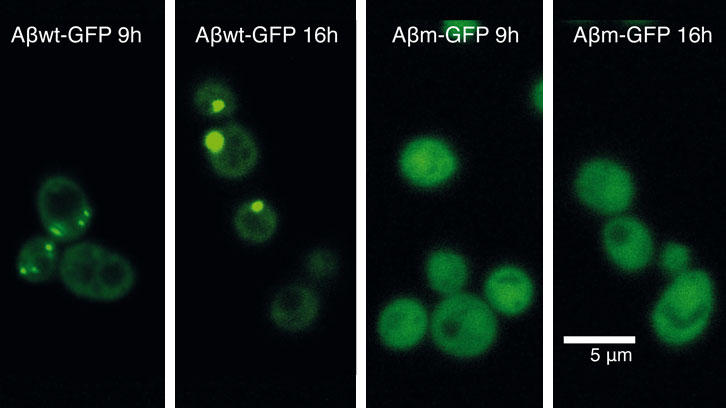
En un primer intent per descobrir com les cèl·lules responen contra el mal plegament de les proteïnes, vàrem expressar 20 pèptids, fusionats amb la proteïna verda fluorescent GFP i que cobrien un rang continu de propensions a agregar. Aquests pèptids els vam dissenyar basant-nos en la seqüencia del pèptid-β-amiloide (Aβ42) (associat a la malaltia d’Alzheimer) i els vam expressar en cèl·lules de llevat. Curiosament, tot i que la major part d’aquests pèptids són altament insolubles, només alguns d’ells són reclutats en agregats intracel·lulars (o cossos d’inclusió). Amb aquest sistema vam poder identificar un llindar de propensió a l’agregació per sobre el qual la cèl·lula comença a acumular activament una proteïna en agregats.
En el treball que comuniquem avui, hem utilitzat dos pèptids d’aquesta col·lecció, que es troben a banda i banda del llindar d’agregació, per desxifrar per què les proteïnes formen o no agregats intracel·lulars. En concret, hem caracteritzat l’impacte que l’expressió d’aquestes dues proteïnes té sobre el benestar cel·lular.
|
|
Figura 2: Una resposta contra les proteïnes desplegades: dues estratègies per al control dels efectes tòxics. El model mostra els diferents costos i beneficis de l’acumulació d’una proteïna mal plegada en agregats. Específicament, aquest diagrama mostra dues proteïnes, majoritàriament insolubles, però situades a banda i banda d’un llindar d’agregació per sobre del qual la cèl·lula acumula activament una proteïna en agregats [11] (a). Aquest procés podria oferir beneficis però també és energèticament costós (cost). Sota el llindar, la proteïna roman difusa pel citoplasma (b). Això podria afavorir la formació d’interaccions nocives que podrien iniciar una cascada de mal plegament i estrès oxidatiu. ROS, espècies reactives a l’oxigen. |
Institut de Biotecnologia i Biomedicina (IBB-UAB)
Referències
Sanchez de Groot, N.; Gomes, R. A.; Villar-Pique, A.; Babu, M. M.; Coelho, A. V.; Ventura, S. Proteome response at the edge of protein aggregation. Open Biology. 2015, vol. 5, num. 2, p. 140221. doi: 10.1098/rsob.140221.
Villar-Pique, A.; Ventura, S. Protein aggregation propensity is a crucial determinant of intracellular inclusion formation and quality control degradation. Biochimica et Biophysica Acta. 2013, vol. 1833, num. 12, p. 2714-2724. doi: 10. 1016/j.bbamcr.2013.06.023.
Sanchez de Groot, N.; Torrent, M.; Villar-Pique, A.; Lang, B.; Ventura, S.; Gsponer, J.; Babu, M. M. Evolutionary selection for protein aggregation. Biochemical Society transactions. 2012, vol. 40, num. 5, p. 1032-1037. doi: 10. 1042/BST20120160.
De Groot, N. S.; Aviles, F. X.; Vendrell, J.; Ventura, S. Mutagenesis of the central hydrophobic cluster in Abeta42 Alzheimer’s peptide. Side-chain properties correlate with aggregation propensities. FEBS Journal. 2006, vol. 273, num. 3, p. 658-668. doi: 10.1111/j.1742-4658.2005.05102.x.