Administración de fármacos dirigidos y terapia oncológica
La administración de fármacos dirigidos a las células malignas es especialmente deseable en la terapia oncológica ya que actualmente, el tratamiento convencional se basa en la administración de fármacos quimioterapéuticos no dirigidos que se distribuyen por circulación sistémica y que pueden provocar la aparición de efectos adversos graves poniendo en peligro la vida del paciente.
En este contexto, el uso de vehículos dirigidos que incluyen conjugado el fármaco activo (generalmente nanopartículas de un tamaño que varía de 10 a 100nm) permite una mayor concentración del fármaco en el lugar de acción y por lo tanto, una mayor eficacia del tratamiento. Sin embargo, la naturaleza xenobiótica y la toxicidad potencial de la mayoría de los nanomateriales estudiados (polímeros, cerámicas, metales y nanotubos de carbono entre otros) plantean serias preocupaciones sobre su bioseguridad. Afortunadamente, las nanobiotecnologías emergentes están impulsando fuertemente el desarrollo de nanoestructuras basadas en proteínas autoensamblables que se caracterizan por ser materiales totalmente biocompatibles.
Las nanopartículas proteicas muestran una alta versatilidad funcional y pueden actuar como ‘virus artificiales’, combinando en la misma entidad diferentes funciones requeridas para un adecuado direccionamiento del fármaco, como por ejemplo, el reconocimiento de un marcador tumoral específico. En este contexto, T22 es un ligando altamente selectivo del receptor de citoquinas CXCR4, que se sobreexpresa en aproximadamente 20 neoplasias humanas y que se correlaciona con la agresividad y la metástasis tumoral.
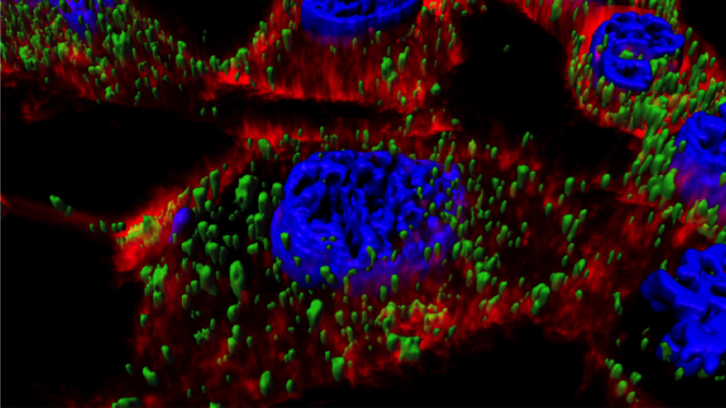
En estudios anteriores, hemos descrito que la proteína autoensamblable T22-GFP-H6 promueve la formación de nanopartículas de unos 12nm y cuando se administra de forma sistémica, muestra una biodistribución óptima en modelos animales de cáncer colorrectal, así como la unión selectiva e internalización en células tumorales. Estas nanopartículas se han utilizado recientemente como potentes transportadores de fármacos antitumorales convencionales y de proteínas citotóxicas en diferentes modelos animales de cáncer, ambos enfoques con alto impacto terapéutico.
Debido a la flexibilidad de esta plataforma, además de diseñar nanopartículas a la carta, permite optimizar los nanoconjugados ya diseñados para mejorar su aplicabilidad como portadores de fármacos. En este sentido, hemos observado que la penetrabilidad de las nanopartículas T22-GFP-H6 es moderada debido a un escaso escape endosomal y la consecuente degradación lisosomal del mismo; un cuello de botella crítico que limita la administración eficiente de los fármacos en el citoplasma celular, tal y como ya se ha descrito para muchos otros nanomateriales proteicos. De acuerdo con esto, la combinación de péptidos dirigidos a las células tumorales y potenciadores del escape endosomal podría ofrecer una estrategia para aumentar la eficacia del nanoconjugado en la célula diana.
En este trabajo hemos estudiado la actividad combinada de T22 y la de una potente proteína formadora de poros, el péptido antimicrobiano GWH1, que se muestra simultáneamente en la superficie de las nanopartículas y que podría actuar como dominio de escape endosomal. Los resultados obtenidos demuestran que la GWH1 tiene una potente actividad endosomolítica, aumentando la transfección eficiente de las nanopartículas en el citoplasma. Sin embargo, la especificidad de unión a CXCR4 se ve ligeramente reducida, pero sin comprometer la eficiencia de las nanopartículas.
En conclusión, la combinación funcional proporcionada por péptidos que reconocen receptores tumorales y péptidos endosomolíticos es un enfoque prometedor para mejorar la eficacia de los nanoconjugados inteligentes diseñados para el tratamiento del cáncer.
Postdoctoral Researcher
Instituto de Biotecnología y de Biomedicina
CIBER-BBN
Universitat Autònoma de Barcelona1
Dra. Esther Vázquez
Researcher
Instituto de Biotecnología y de Biomedicina
Departamento de Genética y Microbiología
CIBER-BBN
Universitat Autònoma de Barcelona2
Referencias
Serna, Naroa & María Sanchez, Julieta & Unzueta, Ugutz & Sanchez-Garcia, Laura & Sánchez-Chardi, Alejandro & Mangues, Ramon & Vázquez, Esther & Villaverde Villaverde, Antonio. (2018). Recruiting potent membrane penetrability in tumor cell-targeted protein-only nanoparticles. Nanotechnology, 30. DOI: 10.1088/1361-6528/aaf959.