Detección no invasiva de la participación del sistema inmunitario en la respuesta a la terapia en glioblastoma en un modelo preclínico de ratón inmunocompetente
Investigadores del Grupo de Aplicaciones Biomédicas de la RMN (GABRMN) de la Universitat Autònoma de Barcelona han utilizado técnicas no invasivas de imagen médica basadas en resonancia magnética, seguidas de análisis con inteligencia artificial, para obtener biomarcadores de respuesta a la terapia en modelos murinos de glioblastoma. En este estudio también se ha detectado la curación de más de la mitad de los animales estudiados, con generación de memoria inmune antitumoral. Esta estrategia podría tener aplicación traslacional a pacientes.
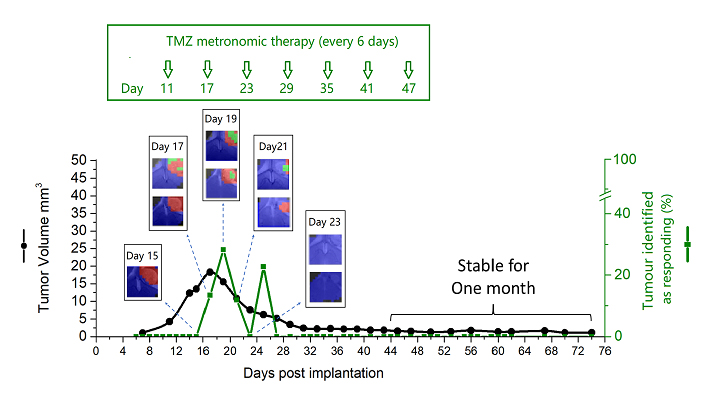
Figura: Evolución del tumor identificada como respuesta (%) y volumen del tumor después del tratamiento de la Planificación Metronómica que Mejora la Inmunidad (IMS-TMZ). Los ratones curados establecieron memoria inmune antitumoral y no se observó ningún crecimiento del tumor tras la reinoculación celular de GL261. Las imágenes se han obtenido con técnicas de resonancia magnética no invasivas y análisis de aprendizaje automático.
Los tumores cerebrales malignos, como los glioblastomas, tienen un gran impacto en la calidad de vida de los pacientes y, sin un tratamiento efectivo, resultan en una supervivencia que no supera el año y medio. Debido a su localización, no es factible realizar biopsias repetidas a los pacientes para comprobar la eficacia del tratamiento. Para hacer este seguimiento, los médicos utilizan técnicas no invasivas, especialmente imagen (y también espectroscopía) de resonancia magnética, aunque la información proveniente de la espectroscopía es de compleja interpretación y muchas veces requiere procesamiento adicional para su correcta utilización por los radiólogos. Por otro lado, cada vez se reconoce más la participación del sistema inmune en la respuesta a la terapia contra el cáncer. Haría falta, no obstante, mejorar el seguimiento no invasivo del tratamiento para saber, lo antes posible, si la terapia administrada es efectiva y si el sistema inmune del paciente está participando de la manera esperada. Saberlo permitiría a los médicos decidir si seguir con un tratamiento concreto o bien cambiar a una estrategia distinta. Para llevar a cabo estudios sistemáticos sobre respuesta a la terapia se utilizan modelos preclínicos (animales) de tumor cerebral, en este caso de ratones con un tumor glial de alto grado como el glioblastoma.
En nuestro estudio, hemos querido seguir sistemáticamente la respuesta a la terapia en ratones, de manera no invasiva, mediante técnicas de resonancia magnética, utilizando además inteligencia artificial para analizar los datos espectroscópicos obtenidos. Ya habíamos demostrado previamente que es posible generar una “imagen de respuesta” basada en el patrón espectral incluso antes de comprobar la disminución del volumen del tumor, y que este “patrón de imagen de respuesta” oscilaba con una frecuencia de 6 días cuando se analizaba a lo largo del tiempo.
En el artículo actual, se ha comprobado esta oscilación en prácticamente todos los casos estudiados que han presentado respuesta. Además, hemos descrito la correlación de este patrón con un aumento de la infiltración de células del sistema inmune, como por ejemplo los macrófagos, en muestras de estos tumores de ratón que se han analizado. Por otro lado, se han estudiado muestras de tumores de ratones que han “escapado” al tratamiento y se ha comprobado que presentaban una expresión aumentada de un receptor llamado PDL-1 relacionado con la capacidad de algunos tipos de cáncer para evadir el sistema inmune.
Uno de los resultados más relevantes que hemos obtenido ha sido la curación de 8 animales (de un total de 17, seguidos hasta punto final*). A estos animales, los cuales han presentado la desaparición del tumor, se les ha repetido la inoculación tumoral, sin recrecimiento tumoral. Se ha comprobado que han desarrollado memoria inmune contra estas nuevas inoculaciones del tumor y que les ha conferido protección.
Como conclusión, el esquema de tratamiento utilizado en los ratones de este estudio ha generado una respuesta inmune antitumoral consistente contra el glioblastoma. Además, nuestros datos sugieren que el método de seguimiento no invasivo de respuesta a la terapia empleado está detectando, in vivo, la eficiencia de la acción del sistema inmune contra el tumor.
*Un seguimiento hasta punto final es aquel que no sacrifica a los animales para estudiar sus muestras. Los animales son estudiados durante toda su vida hasta que se produce una de las situaciones siguientes: a) el tumor vuelve a crecer (en este caso, los animales se sacrifican con fines humanitarios), o b) los animales se curan, y no se requiere más tratamiento.
Shuang Wu1 (+), Pilar Calero-Pérez1, 4(+), Lucia Villamañan1(+), Nuria Arias-Ramos1,4, Martí Pumarola2,4, Sandra Ortega-Martorell3, Margarida Julià-Sapé 4,5, Carles Arús1,4,5, Ana Paula Candiota4,1,5
[+] Los autores y autoras han contribuido igualmente a este trabajo.
1 Departamento de Bioquímica y Biología Molecular, Unitat de Bioquímica de Biociencias, Edifici Cs, Universitat Autònoma de Barcelona (UAB).
2 Unidad de Patología Murina y Comparativa. Departamento de Medicina Animal y Cirugía Animal, Facultad de Veterinaria, UAB.
3 Departamento de Matemática Aplicada, Liverpool John Moores University, Liverpool, UK.
4 Centro de Investigación Biomédica en Red en Bioingeniería, Biomateriales y Nanomedicina (CIBER‐BBN).
5 Instituto de Biotecnología y Biomedicina (IBB), UAB.
Autora de correspondencia: Ana Paula Candiota, Centro de Investigación Biomédica en Red en Bioingeniería, Biomateriales y Nanomedicina (CIBER‐BBN). AnaPaula.Candiota@uab.cat
Referencias
1 Delgado-Goñi T, et al. MRSI-based molecular imaging of therapy response to temozolomide in preclinical glioblastoma using source analysis. NMR Biomed. 2016;29:732-743
2 Arias-Ramos N, et al. Metabolomics of Therapy Response in Preclinical Glioblastoma: A Multi-Slice MRSI-Based Volumetric Analysis for Noninvasive Assessment of Temozolomide Treatment. Metabolites. 2017;7:20